
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамические уравнения состояния
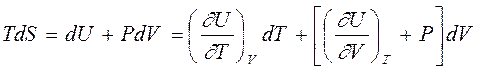 |
Начнем с внутренней энергии, которую в термодинамическом тождестве можно представить через полный дифференциал двух переменных - температуры и объема, тогда
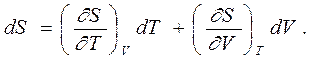 |
Дифференциал энтропии как функции двух переменных (Т,V) можно записать в виде
Сравнивая эти два выражения, находим, что
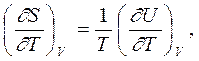 | 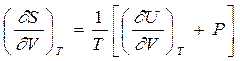 |
Поскольку вторые, перекрестные производные от функции двух переменных должны быть равны независимо от порядка дифференцирования, то есть
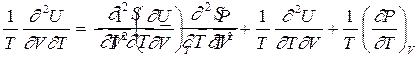 |
то, следовательно,
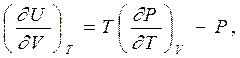 | 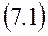 | ||
откуда
и мы имеем термодинамическое уравнение состояния для внутренней энергии (как функции объема при постоянной температуре).
Все величины, стоящие в правой части уравнения (7.1), легко поддаются измерению на опыте, что позволяет найти зависимость внутренней энергии от объема при разных температурах.
Знание этой зависимости позволяет найти разность теплоемкостей при постоянном давлении и постоянном объеме по уравнению (2.6), то есть технически важную характеристику термодинамических объектов.
Если переменными являются другие параметры, то термодинамическое уравнение состояния для внутренней энергии может быть записано просто по аналогии. Например, из уравнения (7.1) можно получить зависимость внутренней энергии аккумулятора от его заряда при разных температурах. Поскольку работа, совершаемая аккумулятором при перемещении по электрической цепи заряда q, равна произведению электродвижущей силы источника тока E(ЭДС) на величину заряда, то элементарная работа имеет вид dA = Edq. Сравнивая работу газа и работу источника тока, то есть dA = PdV и dA = Edq, мы видим, что здесь заряд играет роль объема, а ЭДС источника – роль давления. Теперь по аналогии с уравнением (7.1) можно получить зависимость внутренней энергии аккумулятора от его заряда через температурную зависимость ЭДС
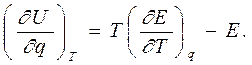 |
аккумулятора
Поскольку температурная зависимость ЭДС при постоянном заряде легко находится опытным путем, то это уравнение приобретает прямую практическую значимость.
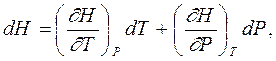 |
Термодинамическое тождество позволяет также получить уравнение, связывающее изменение энтальпии с термодинамическими параметрами. Поскольку H = U + PV, и значит dU = dH - PdV - VdP, а дифференциал энтальпии как функции температуры Т и давления Р имеет вид
то термодинамическое тождество (5.4) после замены dU и dH дает
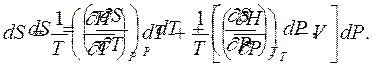 |
В то же время дифференциал энтропии как функции температуры Т и давления Р
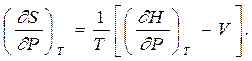 | |||
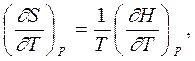 | |||
и, следовательно,
Из равенства перекрестных производных
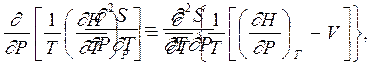 |
получаем
откуда, после раскрытия скобок, окончательно имеем
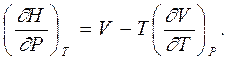 |  | ||
Это - термодинамическое уравнение состояния для энтальпии (как функции давления при постоянной температуре), где правая часть легко определяется опытным путем.
Что касается термодинамических уравнений состояния для двух других термодинамических потенциалов, то есть свободной энергии F и термодинамического потенциала Гиббса G, то они находятся легче и выглядят проще, чем для внутренней энергии и энтальпии. Из уравнения (6.5), которое дает dU = dF + TdS + SdT, и термодинамического тождества TdS = dU + PdV получаем dF = - PdV – SdT.
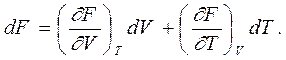 |
С другой стороны, дифференциал свободной энергии как функции объема и температуры
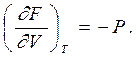 | 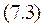 | ||
Сравнивая эти два уравнения, находим скорость изменения свободной энергии в изотермическом процессе при изменении объема
Это термодинамическое уравнение для свободной энергии означает, что если мы знаем давление при некоторой температуре, то мы знаем быстроту изменения свободной энергии с изменением объема и можем вычислить ее изменение в изотермическом процессе.
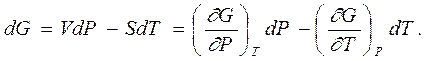 |
Совершенно аналогичным образом находится выражение для дифференциала термодинамического потенциала Гиббса
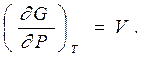 | 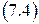 | ||
Отсюда скорость изменения термодинамического потенциала в изотермическом процессе при изменении давления просто равна объему (это еще одно термодинамическое уравнение состояния)
Поскольку объем легко измеряется, то уравнение (7.4) позволяет вычислить изменение термодинамического потенциала Гиббса в изотермическом процессе при изменении давления.
Практический интерес в термодинамике представляют не абсолютные значения термодинамических функций, а их изменения при переходе системы из одного состояния в другое. Поэтому функции находят с точностью до произвольного постоянного слагаемого (и в этом смысле они похожи на потенциальную энергию в механике, которая отсчитывается от произвольного уровня, условно принимаемого за нулевой).
Date: 2015-05-09; view: 699; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |