
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Опыт 2. Влияние температуры на равновесие реакции обратимого гидролиза ацетата натрия
В основе опыта лежит реакция гидролиза ацетата натрия:
CH3COONa + H2O ⇄ NaOH + CH3COOH.
В этой обратимой реакции прямая реакция – гидролиз соли, обратная – нейтрализация. При смещении равновесия в сторону гидролиза образуется сильное основание, присутствие которого может быть установлено малиновым окрашиванием фенолфталеина, добавляемого в реакционную систему в качестве кислотно-основного индикатора.
Реактивы: 0,1 Н раствор ацетата натрия, спиртовый раствор фенолфталеина.
Посуда и принадлежности: пробирки, спиртовка, спички, держатель для пробирок.
Методика проведения опыта. Налейте в пробирку 3-4 мл раствора ацетата натрия и добавьте 1-2 капли раствора фенолфталеина. Нагрейте жидкость до кипения. В наблюдениях отметьте окраску раствора до и после нагревания. Охладите пробирку. Отметьте, изменился ли цвет жидкости в пробирке после охлаждения. Объясните, почему окраска фенолфталеина изменяется при нагревании и охлаждении.
Напишите выражение константы равновесия для данной реакции.
В выводах укажите:
– с какими тепловыми эффектами протекают прямая и обратная реакции и почему;
– каково направление смещения химического равновесия в данной реакции при повышении температуры и что является причиной этого.
Опыт 3. Влияние температуры на обратимую реакцию и установление термохимического типа прямой и обратной реакции (УИРС)
При действии раствора иода на крахмал образуется комплексное соединение – иодкрахмал, имеющий характерное синее окрашивание:
(С6Н10О5)n + m I2 ⇄ (С6Н10О5)n· m I2; ΔΗ =?
бесцветноежелтая синяя
соединение окраска окраска
Реактивы: раствор иода в воде (c желтой окраской средней интенсивности), свежеприготовленный крахмальный клейстер (приготовить суспензию из 0,5 г крахмала в 10 мл холодной воды, вылить ее в 150 мл горячей воды и довести до кипения).
Посуда и принадлежности: пробирки, спиртовка, спички, держатель для пробирок.
Методика проведения опыта. Налейте в пробирку 2-3 мл раствора крахмального клейстера, добавьте несколько капель раствора иода. Отметьте и запишите в графе "Наблюдения" окраску полученного раствора. Нагрейте пробирку на спиртовке. Отметьте изменение окраски. Пробирку охладите под струей воды из-под крана. Отметьте, что происходит с окраской раствора при охлаждении.
В выводах укажите направления смещения химического равновесия в данной обратимой реакции соответственно при повышении и понижении температуры, а также знаки тепловых эффектов прямой и обратной реакций. Объясните причины этого.
Тема 4. Гетерогенные химические системы и поверхностные явления в них (спецраздел с элементами УИРС) (базовый материал)
Рекомендуемая литература по теме 4 приведена на с. 30.
Гетерогенные химические системы (ГХС) состоят из нескольких фаз.
Фаза – это часть ГХС, однородная по химическому составу и агрегатному состоянию во всех своих точках и отделенная от других частей системы границей раздела (межфазной поверхностью).
Гетерогенные химические системы бывают со сплошными границами раздела фаз (например, жидкость в емкости в контакте с воздухом), а могут быть дисперсными.
Дисперсные ГХС – гетерогенные системы, в которых частицы одной фазы, называемой дисперсной, находятся в раздробленном (диспергированном) состоянии и равномерно распределены между частицами другой фазы, называемой дисперсионной средой. Например, сырая нефть – это гетерогенная дисперсная система (ГДС). В ней диспергированные частицы природной воды, горных пород, газов равномерно распределены между частицами углеводородной дисперсионной среды. Эта система стабилизирована вследствие действия имеющихся в ней природных (нефтяных) поверхностно-активных веществ (ПАВ). В отличие от гомогенных дисперсных систем (истинных растворов), размеры частиц дисперсной фазы в гетерогенных дисперсных системах (ГДС) превышают ионно-молекулярный уровень.
Природа веществ, образующих фазы, различна, поэтому на межфазной поверхности (МП) возникают нескомпенсированные молекулярные силы и, как результат, избыточная поверхностная энергия Гиббса:
DGпов = s . S, кДж,
где S (м2) – суммарная площадь поверхности раздела фаз, s (кДж/м2) – удельная поверхностная энергия Гиббса, т.е. приходящаяся на единицу поверхности раздела фаз. Для систем с конденсированными фазами s называют поверхностным натяжением.
Стремление ГХС уменьшить значение DGпов обусловливает возникновение в них поверхностных явлений: смачивание, адгезия, сорбция (адсорбция или абсорбция), а в гетерогенных дисперсных системах еще возникает агрегация и коагуляция.
Смачивание – это межмолекулярное взаимодействие на границе раздела фаз между веществами двух конденсированных фаз (жидкость – жидкость или твердое тело – жидкость), находящихся в контакте с газовой фазой. Полное (растекание) или частичное смачивание поверхности одной фазы веществом другой фазы оказывается возможным только если эти вещества способны к какому-либо межмолекулярному взаимодействию (силы Ван-дер-Ваальса, водородные связи и др.).
Адгезия – это смачивание, завершаемое прилипанием одной фазы к поверхности другой фазы.
Когезия – это взаимодействие между частицами вещества внутри одной фазы.
Адсорбция – это концентрирование вещества, растворенного в одной фазе (эта фаза представляет собой истинный раствор), на поверхности другой фазы, т.е. на границе раздела фаз. Вещество, которое адсорбируется – адсорбат; вещество, на поверхности которого происходит адсорбция – адсорбент. Процесс адсорбции обратим и достигает состояния равновесия. Обратный процесс – десорбция.
В основе адсорбции лежит тот или иной вид межмолекулярного взаимодействия между адсорбатом и адсорбентом на границе раздела фаз. Существует правило: подобное адсорбируется на подобном, т.е. полярные вещества адсорбируются на полярных адсорбентах и наоборот.
Смачивание и адсорбция приводят к частичной компенсации нескомпенсированных молекулярных сил на границе раздела фаз и в результате – к снижению удельной поверхностной энергии s, а, следовательно, и к уменьшению DGпов.
Особую роль играет адсорбция поверхностно-активных веществ (ПАВ). Молекулы ПАВ дифильны, они в своей структуре имеют одновременно неполярный гидрофобный фрагмент и полярный гидрофильный фрагмент. Благодаря такому строению молекулы ПАВ могут адсорбироваться на любой межфазной поверхности: полярной частью на полярной поверхности, а неполярной частью на неполярной поверхности.
В результате адсорбции ПАВ происходит уравнивание полярностей поверхностей фаз на границе их раздела и, как результат – снижение s и DGпов.
Отличительным признаком действия ПАВ является возрастание эффекта снижения поверхностного натяжения s по мере увеличения концентрации ПАВ (т.е. степени адсорбции) на границе раздела фаз (до момента достижения равновесия).
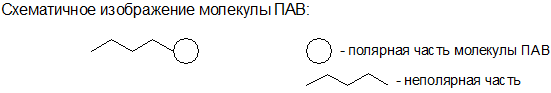
Разновидностью ПАВ являются мыла. Мыла представляют собой растворимые соли карбоновых кислот с числом атомов углерода С14-С20. Такие кислоты образуются при гидролизе жиров, поэтому им дали название «жирные кислоты». Мыла ROO-M+ (M+ = Na+, K+; R – углеводородный остаток) представляют собой водорастворимые анионактивные ПАВ, т.к. при их диссоциации в воде образуется поверхностно-активный анион ROO-:

Примером действия ПАВ является стабилизация эмульсии, образующейся из сырой нефти и воды в присутствии природных поверхностно-активных веществ:
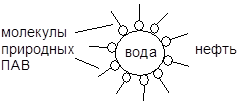
Гетерогенные дисперсные системы (ГДС) имеют громадное множество границ раздела между частицами дисперсной фазы и дисперсионной среды. В результате этого суммарная площадь поверхности раздела фаз (S) и, следовательно, DGпов в ГДС очень значительны. Гетерогенные дисперсные системы имеют возможность самопроизвольно уменьшить величину S путем слипания или слияния частиц дисперсной фазы. Такое явление называется агрегацией. В результате укрупнения частиц дисперсной фазы их масса растет, и в какой-то момент происходит их оседание под действием сил тяжести. Такое явление называется седиментацией.
Агрегация, приводящая к седиментации и имеющая необратимый характер, называется коагуляцией. В результате коагуляции происходит разрушение ГДС.
Стабилизация ГДС может быть достигнута в результате адсорбции ПАВ или возникновения двойного электрического слоя на границах раздела частиц дисперсной фазы и дисперсионной среды. Возможность действия этих факторов определяется природой частиц фазы и среды.
В зависимости от размера частиц дисперсной фазы ГДС подразделяются на коллоидные растворы (размер частиц фазы 10-7 – 10-5 см) и взвеси (размер частиц фазы более 10-5 см). Взвеси подразделяются на микрогетерогенные системы (размер частиц 10-5 – 10-3 см) и грубодиспер-сные системы (размер частиц 10-3 – 1 см).
По агрегатному состоянию дисперсной фазы и дисперсионной среды ГДС подразделяются на следующие разновидности (табл. 1.8):
Таблица 1.8 – Разновидности гетерогенных дисперсных систем
| Дисперсионная среда | Дисперсная фаза | Обозначение (фаза/среда) | Название |
| Газообразная (Г) | Жидкая (Ж) Твердая (Т) | Ж/Г Т/Г | Аэрозоли |
| Жидкая (Ж1) | Газообразная (Г) Жидкая (Ж2) Твердая (Т) | Г/Ж1 Ж2/Ж1 Т/Ж1 | Жидкие пены Эмульсии Суспензии |
| Твердая (Т1) | Газообразная (Г) Жидкая (Ж) Твердая (Т2) | Г/Т1 Ж/Т1 Т2/Т1 | Твердые пены, пористые тела Капиллярные системы, твердые эмульсии Сплавы, минералы |
Рекомендуемая литература по теме 4:[1], гл. 10, §§ 10.1-10.3, 105, 108; [2], гл. 6, §§ 6.5, гл. 8, §8.7; [4], гл. 9, § 1-6.
Date: 2015-05-08; view: 4669; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |