
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

свободную энергию Гельмгольца F
u U – внутренняя энергия – сумма потенциальной энергии взаимодействия всех частиц в системе и кинетической энергии их движения.
u Экспериментально можно определить только ∆U при взаимодействии с окружающей средой.
u 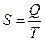 S – энтропия -мера неупорядоченности в системе, т. е. неоднородности расположения и движения частиц.
S – энтропия -мера неупорядоченности в системе, т. е. неоднородности расположения и движения частиц.
u Энтропия измеряется в Дж/моль∙К и рассчитывается по уравнению Больцмана:
S=k∙lnW; k - постоянная Больцмана.
W – термодинамическая вероятность, т. е. число микросостояний, которыми может быть осуществлено данное макросостояние.
u Величину S можно рассчитать
u для простых, сложных веществ и химических процессов. Обычно это делается при стандартных условиях и значения S0 для простых и сложных веществ приводятся в справочниках.
u Для химических реакций справедливо:
u Δ S0 р-ии = ΣΔ S0i (продуктов) - ΣΔ S0i (исходных веществ).
u Н – энтальпия – теплосодержание системы.
u Изменение энтальпии (ΔН) – это тепловой эффект реакции при р = const.
u QР = -Δ Н.
u Изменение энтальпии при стандартных условиях - Δ Но.
u Для простых веществ Δ Но = 0;
u Cтандартная энтальпия образования сложного вещества – это изменение энтальпии при получении 1 моль этого вещества из простых веществ (это величины табличные, единицы измерения кДж/моль).
u Для определения Δ Но реакции справедливо:
u Δ Н0 р-ии = Σ Δ Н0i (продуктов) - Σ Δ Н0i (исходных веществ).
• G - энергия Гиббса – (изобарно-изотермический потенциал) –
• мера устойчивости системы при р = const, Т = const.
• Она учитывает совместное влияние энтальпийного фактора (стремление системы к минимуму энергии) и энтропийного фактора (стремление системы к беспорядку)
• ее изменение -∆G°рассчитывается в кДж/моль по формуле:
• ΔG° = Δ Н0 - ТΔS0:
• для простых веществ ΔG° = 0,
• для индивидуальных веществ ΔG° табличные данные;
• ΔG 0 р-ии = Σ ΔG 0i (прод.) - Σ ΔG 0i (исх. В-в).
• F – энергия Гельмгольца
• (изохорно - изотермический потенциал)
• ΔF°=∆U°-T∆S°
• Термохимия - это раздел химии, изучающий тепловые эффекты химических процессов.
• I закон термохимии Лавуазье-Лапласа гласит:
• Тепловой эффект образования данного соединения равен тепловому эффекту его разложения, но имеет противоположный знак.
• II закон термохимии Гесса:
• Тепловые эффекты химических реакций, протекающих при постоянном объёме или постоянном давлении, зависят только от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций.
• C + 1 / 2 О 2 = СО СО + 1 / 2 О 2 = СО 2
•  DН 2 DН 3
DН 2 DН 3
•
•
• С (Т) + О 2(Г) = СО 2 DН 1
• т.к. DН1=DН2 + DН3.
• С + О2 = СО2 (DН1= –94 ккал)
• Из закона Гесса вытекают 2 следствия:
• 1 следствие: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции (S DН˚ прод.) и суммой теплот образования исходных веществ (S DН˚ исх.в-в), взятых с соответствующими стехиометрическими коэффициентами.
• Математическое выражение этого следствия:
• DН˚ = S DН˚ прод. – S DН˚ исх.в-в
• 2 следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, взятых с учётом стехиометрических коэффициентов.
• Первый закон термодинамики является следствием закона сохранения энергии: разные формы энергии переходят друг в друга в строго эквивалентных количествах.
• В зависимости от типа системы закон имеет различные формулировки.
• Для изолированных систем: внутренняя энергия т.с. постоянна (∆U=0).
• Для закрытых систем: сообщаемая системе теплота расходуется на увеличение внутренней энергии и совершение работы против внешних сил: т. е. Q=∆U+A=∆U+P∆V.
• В изохорном процессе (V= const) A=0, тогда QV =∆U (тепло расходуется только на изменение внутренней энергии).
• В изобарном процессе (р=const).
• Qp= ∆U+P∆V = (U2-U1) + (РU2-РU1) = U2 - U1 + PV2-PV1 = (U2+PV2) - (U1+ PV1) = = H2 - H1 = ∆H; QР=∆H, т.е
• тепло расходуется только на изменение энтальпии, причем если тепло поглощается (-Q) энтальпия увеличивается:
• т.е Q=-∆H.
• В открытых биологических системах теплота отдаётся во внешнюю среду, а работа совершается за счёт убыли внутренней энергии:
• Q=∆U-A
• Второй закон термодинамики определяет направленность и пределы протекания процессов Самопроизвольным является процесс, который совершается без затраты работы извне.
• В изолированных системах самопроизвольно могут совершаться только такие необратимые процессы, при которых энтропия системы растет (∆S>0).
• Для других систем в изобарно-изотермических условиях самопроизвольно могут протекать только такие процессы, в результате которых ∆G<0.
• Реакции, для которых ∆G<0 называются экзергонические, ∆G>0 – эндергонические.
• В организме человека протекают и эндергонические реакции, но обязательным условием этого является их сопряжение с экзергоническими реакциями. Это возможно если обе реакции имеют какое-либо общее промежуточное соединение.
• Химическое равновесие.
• С точки зрения обратимости химические реакции бывают:
• необратимые - идут в одном направлении до полного израсходования одного из реагирующих веществ.
• обратимые – одновременно могут протекать две взаимно противоположные реакции.
• Обратимые реакции заканчиваются наступлением химического равновесия, когда Vпр = Vобр и G→min (значит ∆G→0); концентрации называются равновесными и сохраняются неизменными.
• Особенности состояния химического равновесия:
• оно динамическое; прямая и обратная реакции не прекращаются, а протекают с равными скоростями.
• равновесие подвижно, т.е. при изменении внешних условий происходит смещение равновесия (ускорение одной из реакций) и наступление нового равновесия при других равновесных концентрациях в соответствии с принципом Ле-Шателье:
• если на систему, находящуюся в состоянии химического равновесия подействовать изменением внешних факторов (P,C,T), то в системе усилится тот процесс, который препятствует этому воздействию.
• Для гомогенной реакции: аА + вВ ↔ сС + dD константа равновесия имеет вид:
• Kp=[C]c∙[D]d / [A]a∙[B]b;
• Кр зависит от природы веществ и температуры (для экзотермического процесса при понижении температуры Кр увеличивается; для эндотермического – уменьшается) и не зависит от концентраций. По величине Кр можно судить о направлении и глубине процесса в данных условиях.
• lgКр=-ΔG0 / 2,3RT
• Если Кр>1 равновесие смещено вправо (ΔG0р-ции<0).
• Если Кр<1 равновесие смещено влево (ΔG0>0)
• Если Кр=1 система находится в состоянии равновесия (ΔG0=0).
• Применение законов термодинамики к живым системам
• Теплота, выделяющаяся из организма, равна теплоте, найденной путём подсчёта по окислению веществ,
• т.е. I закон применим к жизненным процессам.
• Долгое время считалось, что II закон термодинамики неприменим к живым системам. Необходимо учитывать:
• Биологические системы обмениваются со средой энергией и массой.
• Процессы в живых организмах в конечном счёте необратимы.
• Живые системы не находятся в равновесном состоянии.
• Все биологические системы гетерогенны, многофазны.
• В живом организме (открытая система) вместо термодинамического равновесия наступает стационарное состояние, которое характеризуется не равенством прямого и обратного процессов, а постоянством скорости химических изменений и отводом метаболитов.
u Стационарное состояние и равновесие отличаются тем, что энтропия закрытой системы при равновесии достигает максимума, а в открытой системе при стационарном состоянии энтропия находится на постоянном, но отличающемся от максимума уровне.
u При равновесии изменения свободной энергии не происходит, а в стационарном состоянии свободная энергия изменяется непрерывно, но с постоянной скоростью.
u При стационарном состоянии скорость реакции в одном направлении закономерно больше, чем в другом, и разность скоростей постоянна во времени.
u Живые системы избегают смертного приговора второго закона термодинамики благодаря тому, что они непрерывно обмениваются с окружающей средой как энергией, так и веществом.
В 1946-1960 гг. И.Пригожин При отклонении системы от стационарного состояния в ней наступают внутренние изменения, которые будут стремиться приблизить систему к стационарному состоянию.
dS=dSl +dSi
dSl Ð0 внутри организма
dSi >0 изменение при связи с внешней средой
/dSl/> / dSi /
2 формулировка з-на: Стационарное состояние ЖО соответсвет минимальный прирост энтропии: dS→ min
Date: 2015-05-08; view: 455; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |