
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изохорный процесс. Изохорным называется процесс, протекающий при постоянном объеме
Изохорным называется процесс, протекающий при постоянном объеме.
Уравнение изохорного процесса в диаграмме 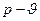 :
:
ϑ= const. (1)
Зависимость между изменяющимися параметрами можно установить из уравнения состояния:
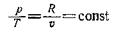
|
откуда:
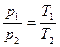 . (2)
. (2)
т.е., давление изменяется прямо пропорционально абсолютной температуре. Это означает, что при подводе теплоты к газу (нагревание) его давление и температура увеличиваются, при отводе теплоты (охлаждение) – уменьшаются.
При 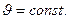 имеем:
имеем: 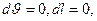 следовательно, в этом процессе работа не совершается и поэтому подводимая теплота полностью расходуется на изменение внутренней энергии газа:
следовательно, в этом процессе работа не совершается и поэтому подводимая теплота полностью расходуется на изменение внутренней энергии газа:
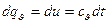
Изменение внутренней энергии идеального газа не зависит от свойств или характера процесса, поэтому приведенное выше уравнение действительно для неравновесных, необратимых процессов.
Изменение энтальпии подсчитывается по уравнению:
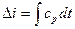 ,
,
так же, как подсчитывается количество теплоты процесса p=const:
В соответствии со свойствами энтальпии можно отметить, что и в этом случае это уравнение может быть использовано для расчета изменения энтальпии рабочего тела при протекании неравновесных, необратимых процессов.
В координатах 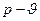 изохора изображается вертикальной линией, направленной вверх при нагревании и, вниз – при охлаждении (рис.1).
изохора изображается вертикальной линией, направленной вверх при нагревании и, вниз – при охлаждении (рис.1).
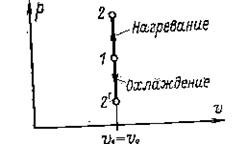 |
Рис. 1. Изохорный
Изобарный процесс. Процесс, протекающий при постоянном давлении, называется изобарным В координатной системе 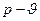 изобара изображается прямой /—2, параллельной оси Х.
изобара изображается прямой /—2, параллельной оси Х.
Уравнение изобарного процесса в координатах 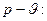
P=const,
Зависимость между переменными значениями удельных объемов и абсолютных температур известна из закона Гей-Люссака:
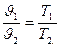
Таким образом, при увеличении объема газа температура его повышается, при уменьшении объема — понижается.
Работа расширения на рис. 2 изображается заштрихованной площадью под линией 1 — 2 и определяется по уравнению:

Количество теплоты, подведенной к газу в изобарном процессе, можно найти по уравнению
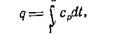
|
откуда имеем:
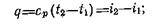
|
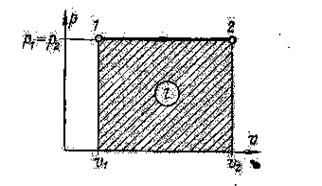
Рис. 2. Изобарный процесс.
Изотермический процесс. Процесс, протекающий при постоянной температуре, называется изотермическим.
В соответствии с уравнением состояния для идеального газа получим:
pv=RT=const.
поэтому уравнение процесса, выражающее закон Бойля— Мариотта, имеет вид:
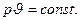
В координатах pv изотермический процесс изображается гиперболической кривой (Рис.3), т. е. линией, симметрично расположенной относительно координатных осей.
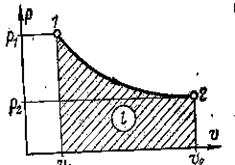
Рис. 3. Изотермический процесс.
Из уравнения изотермического процесса следует:
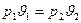 ,
,
или:
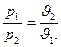
Таким образом, при постоянной температуре давление газа изменяется обратно пропорционально его объему (закон Бойля — Мариотта).
Изменения внутренней энергии и энтальпии идеального газа зависят только от температуры, поэтому в изотермическом процессе:
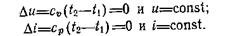
Тогда, в соответствии с первым законом термодинамики:
q=l,
т. е., в изотермическом процессе вся теплота, сообщаемая газу, расходуется полностью на работу расширения. Найдем работу процесса, воспользовавшись уравнением:
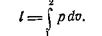
Так как:
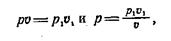
|
то:
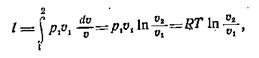
|
Адиабатный процесс. Адиабатным называется процесс, который осуществляется без теплообмена между газом и внешней средой. Известно, что любой термодинамический процесс можно представить как последовательность элементарных (бесконечно малых) процессов. В каждом таком процессе в данном случае теплота не подводится и не отводится, поэтому характеристикой процесса служит равенство dq=0.
Уравнение процесса найдем путем совместного решения уравнений состояния и первого закона термодинамики. При dq=0 имеем:
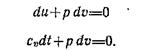
Подставляя cv=R/(k—1), получаем:
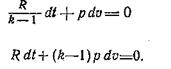
Дифференцирование уравнения pv=R.T дает выражение
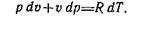
Дальнейшие преобразования приводят к следующему выражению:
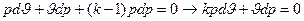
Путем деления последнего выражения на pϑ получаем:
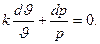
Интегрирование последнего выражения и потенцирование логарифмического выражения позволяет получить уравнение адиабатного процесса в диаграмме p-ϑ:
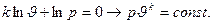
Уравнение 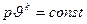 и есть уравнение адиабатного процесса. В диаграмме p-ϑ адиабатный процесс изображается кривой линией, близкой к гиперболе.
и есть уравнение адиабатного процесса. В диаграмме p-ϑ адиабатный процесс изображается кривой линией, близкой к гиперболе.
Из уравнения для адиабатного процесса устанавливаем связи между параметрами:
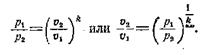
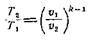
|
Работа процесса совершается за счет внутренней энергии газа и может быть рассчитана с помощью следующих выражений:

|
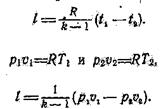
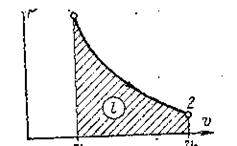
Рис. 4. Адиабатный процесс.
Политропные процессы. Политропным называется всякий обратимый термодинамический процесс, который подчиняется уравнению
Pϑn=const, (1)
где показатель «п» может иметь любое значение от — 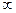 до +
до + 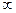 .
.
Для каждого процесса показатель п — величина постоянная. Из уравнения (1) можно получить соотношения между параметрами р и ϑ для каких-либо произвольных состояний, характеризуемых точками 1 и 2, политропного процесса, а именно:
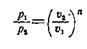 (2)
(2)
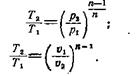
Для расчета количества работы в политропном процессе можно использовать следующие выражения:
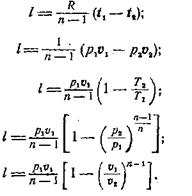 (3)
(3)
Выражение для определения теплоемкости политропного процесса имеет следующий вид:
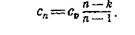 (4)
(4)
Количество теплоты, расходуемой в политропном процессе, может быть подсчитано непосредственно по уравнению
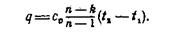 (5)
(5)
где k = cр \ cϑ находится в зависимости от атомности газа.
Показатель политропы «п» можно найти расчетным путем, логарифмируя соотношения между любой парой основных параметров, определяемых из уравнений (1-2).
Например, если точки 1 и 2 принадлежат политропе, то из уравнения (1) имеем:
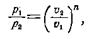 (6)
(6)
откуда после логарифмирования находим:
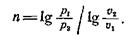 (7)
(7)
Таким же путем можно найти показатель n, если в начальном и конечном состояниях политропного процесса будут известны одновременно значения р и Т или Т и ϑ.
Date: 2015-05-08; view: 1093; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |