
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства воды и особенности ее строения
ЧАСТЬ 1.ОБЩИЕ СВЕДЕНИЯ О ХИМИЧЕСКОМ СОСТАВЕ
И СВОЙСТВАХ ВОДЫ
1.Свойства воды и особенности ее строения........................................ 3
2.Основные компоненты и факторы формирования химического состава подземных вод............................................................ 6
3.Ионный состав воды и свойства воды, зависящие от ионного
состава …………………………………………………………………. 6
4.Аналитическая обработка данных ионного состава воды…………… 9
5. Графические способы изображения химического состава воды…….. 12
6. Характеристика и оценка свойств воды……………………………….. 15
7. Пригодность воды для практического использования …………..…... 15
ЧАСТЬ II. ВЫПОЛНЕНИЕ ЛАБОРАТОРНОЙ РАБОТЫ ПО ОБРАБОТКЕ ДАННЫХ ХИМИЧЕСКОГО АНАЛИЗА И ОЦЕНКЕ СВОЙСТВ
ПОДЗЕМНЫХ ВОД.
У.1. Пересчитать данные химического анализа воды из ионной (мг\л) в
эквивалентную (мг-экв/л) и процент-эквивалентную (%-экв) форму….17
У.2. Составить формулу Курлова и дать характеристику воды по
классификации Алекина ……………………………………………… 19
У.3. Изобразить результаты химического анализа воды в виде диаграммы, на графиках-треугольниках и на графике–квадрате Толстихина. 21
У.4. Дать оценку некоторых свойств воды – общей минерализации,
жесткости, кислотности…….……………………………………….. 28
У.5. Определить пригодность воды для хозяйственно-питьевого
водоснабжения………………………………………………………… 31
ЧАСТЬ 1. ОБЩИЕ СВЕДЕНИЯ О ХИМИЧЕСКОМ СОСТАВЕ И
СВОЙСТВАХ ВОДЫ.
Свойства воды и особенности ее строения
Вода важнейшее вещество биосферы, без которого невозможна жизнь. Многие свойства воды уникальны (таблица 1) и не воспринимаются как необычные только из-за ее повсеместного распространения.
Эти аномалии воды объясняют структурой ее молекулы, в которой два атома водорода и атом кислорода образуют треугольник с углом при вершине (у атома кислорода) – 1050 (рис.1А). Хотя молекула в целом нейтральна, отрицательный суммарный заряд сосредоточен на одной стороне, а общий положительный заряд – на другой. Именно полярность молекулы воды в конечном итоге и обуславливает ее уникальные свойства. Притяжение атома водорода одной молекулы воды к отрицательно заряженной стороне другой молекулы создает водородную связь и обуславливает возможность образования полимеров и полиморфных превращений жидкой воды. Однако единой модели, которая могла бы описать все известные свойства воды и водных растворов при различных условиях, до сих пор еще не создано.
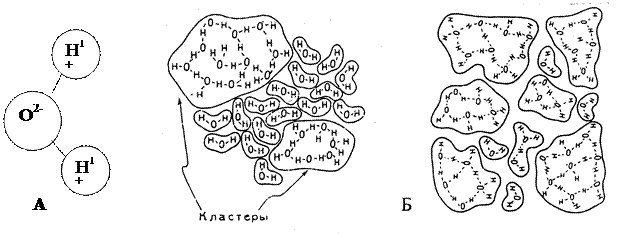

Рис.1. Строение молекулы воды (А) и возможные варианты группировок молекул в структуре жидкой воды (Б).
Всем известная формула воды (Н20) соответствует молекулярному весу водяного пара. В жидком состоянии вода вместе с простыми молекулами содержит и более сложные образования, соответствующие формуле (Н2О)n. Нередко воду представляют как смесь дискретных структурных группировок молекул воды (кластеров), отличающихся друг от друга состоянием водородных связей (рис. 1Б).
Экспериментальные данные свидетельствуют, что после обработки воды в автоклавах при температуре 300-4000С и давлениях около 100 Мпа усиливается растворяющая способность воды по отношению ко многим минералам, уменьшается рН, изменяется электропроводность. Такое состояние воды называют активированным. Строение кластеров воды изменяется и под действием других внешних условий: например, магнитных и электромагнитных полей. При этом «наведенные» свойства сохраняются некоторое время после снятия внешнего воздействия.
Таблица 1.
Некоторые аномальные свойства воды и их биологическое значение.
| Свойства воды | Сравнение со свойствами других веществ. | Влияние на физико-биологическую характеристику среды. |
| Теплоемкость | Самая высокая для всех твердых и жидких веществ, кроме жидкого NH3. | · Препятствует чрезмерным перепадам температуры · Очень велик перенос тепла при движении воды. · Поддержание одинаковой температуры тела. |
| Теплота плавления | Самая высокая, кроме NH3 | Эффект термостатирования в точке замерзания за счет поглощения или выделения теплоты. |
| Теплота испарения | Самая высокая | Чрезмерно важна в процессах теплопереноса и в кругообороте воды в атмосфере |
| Тепловое расширение | Температура, соот- ветствующая максимальной плотности (40С для чистой воды), при увеличении солености уменьшается. | Пресная и разбавленная морская вода имеет максимальную плотность при температурах выше точки замерзания. Это важно в вертикальной циркуляции воды в водоемах. |
| Поверхностное натяжение | Наиболее высокое по сравнению с другими жидкостями | Важно для физиологии клетки. Регулирует некоторые поверхностные эффекты, образование капель и их свойства. |
| Растворяющая способность | Растворяет больше веществ, чем любая жидкость и в большей степени. | Влияет на физические и биологические явления. |
| Диэлектричес-кая проницаемость | Максимальная по сравнению со всеми жидкостями. | Способствует сильной диссоциации растворенных неорганических веществ. |
| Электролити-ческая диссоциация | Очень мала | Нейтральное вещество, однако, содержит ионы Н+ и ОН- |
| Прозрачность | Относительно велика | В ИК и УФ областях спектра велико поглощение энергии излучения. В видимой области мало селективное поглощение, отсюда «бесцветность» воды. |
Изменения квазикристаллической структуры воды оказывает значительное влияние на её биохимические свойства.
Омагниченную воду широко применяют при подготовке посадочного материала в сельском хозяйстве Вода, обладающая признаками активированности, обнаружена во многих термальных источниках. С этим, возможно, связаны целебные свойства, по крайней мере, некоторых типов минеральных вод.
Природная вода состоит из трех стабильных изотопов кислорода и двух стабильных изотопов водорода. Из 9 изотопных молекул абсолютно преобладает «нормальная (обычная) вода» H216O (99.73% молекулярной концентрации). Особое внимание привлекает тяжелая вода – HD16O (0.03%) и D216O (2,3·10-6%). В ней не прорастают семена, она смертельна для водных организмов и вообще не поддерживает биохимические процессы. Тяжелая вода имеет плотность 1,1 г/см3 (максимальную при температуре +11,60С); температура ее кипения – 101,40С, а плавления льда – 3,80С. По вязкости, поверхностному натяжения и другим признакам она также сильно отличается от простой воды.
Определение химического состава воды никаких трудностей не представляет, это простейшее химическое соединение двух объемов водорода с одним объемом кислорода – по весу она состоит из 11,11% водорода и 88,89% кислорода. Поэтому, когда говорят о химическом составе воды, то имеют в виду вовсе не соотношение химических элементов, входящих в ее формулу, а содержание посторонних для этой жидкости веществ, в том числе находящихся в растворенном состоянии.
Date: 2015-06-08; view: 1073; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |